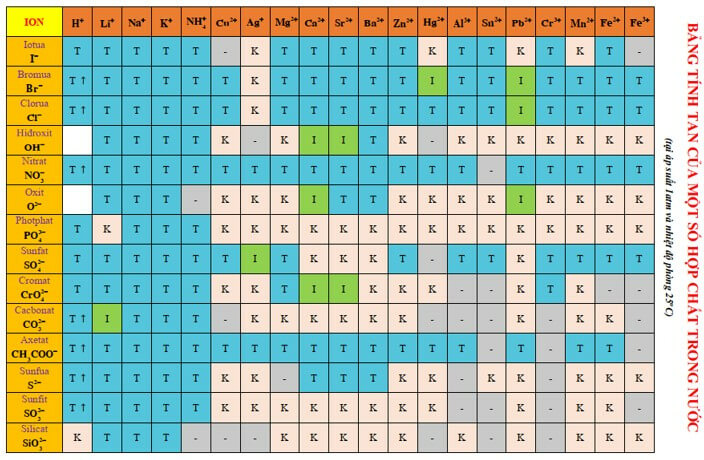
Bảng tính tan là phần nội dung kiến thức không thể thiếu trong bộ môn hóa học 11. Thông qua bảng tính tan bạn có thể nhận biết được tính tan các chất trong nước, chất kết tủa, chất bay hơi….
Với lượng thông tin lớn như vậy sẽ rất khó ghi nhớ đối với các bạn học sinh. Vậy hãy theo dõi bài viết dưới đây của chúng tôi để nắm chắc được kiến thức và cách ghi nhớ bảng tính tan hiệu quả nhé!
Định nghĩa về độ hòa tan
Độ hòa tan hay độ tan cho thấy khả năng hòa tan một chất trong dung môi để tạo thành một chất bão hòa trong nhiệt độ nước.
Để xác định được chất tan hay không không tan có thể dựa vào thông tin sau:
- Nếu lấy trên 10g chất đố có thể hòa tan được trong 100g nước hòa tan thì chát này được gọi là chất tan hay chất dễ tan.
- Nếu chỉ dưới 1g chất đó được hòa tan trong 100g nước thì chất đó được gọi là chất ít tan.
- Nếu chỉ 0,01g chất đó được hòa tan trong 100g nước hòa tan thì chất đó được gọi là chất không tan.
Bảng tính tan hóa học 11 đầy đủ
Dưới đây là bảng tính tan hóa học 11 đầy đủ bạn nên tham khảo
Ghi chú:
- T: chất dễ tan
- I: chất ít tan
- K: chất không tan
- B: chất bay hơi
- -: chất không tồn tại hoặc bị nước phân hủy
Cách đọc bảng tính tan:
Bảng tính tan bao gồm các cột hàng hàng ngang và hàng cột dọc. Trong đó cột dọc là các cation kim loại, còn hàng là các anion gốc axit. Thông qua bảng tính tan, chúng ta có thể xác định được ion dương và ion âm gióng theo hàng và cột tương ứng để biết được trạng thái của chất đó tại một ô.
Các yếu tố ảnh hưởng đến độ tan của một chất
Tính tan của một chất được tác động bởi nhiều yếu tố khác nhau, cụ thể là các yếu tố ảnh hưởng đến độ tan của một chất như sau:
1. Nhiệt độ
- Đối với chất khí, độ tan của chất sẽ tỷ lệ nghịch với nhiệt độ trong dung môi.
- Chất rắn thu nhiệt thì khi nhiệt độ càng cao sẽ khiến độ hòa tan của của chất đố càng lớn.
- Chất rắn tỏa nhiệt khi nhiệt độ càng giảm thì độ hòa tan của chất càng tăng.
2. Áp suất
Các chất khí có độ tan nhỏ và áp suất không quá cao thì khi tăng áp suất bề mặt chất lỏng không đổi, thì lượng chất khí hòa tan trong 1 thể tích chất lỏng sẽ tăng và ngược lại.
3. Độ phân cực của chất tan và dung môi
- Các chất phân cực sẽ thường dễ tan hơn trong môi trường dung môi phân cực. ví dụ như: kiềm, nước, dung dịch muối/axit vô cơ,….
- Chất ít phân cực sẽ dễ tan trong môi trường dung môi hữu cơ kém phân cực. ví dụ như: benzene, chloroform, dichloromethane,….
4. Dạng hình thù
Thông thường các loại chất rắn dạng vô định hình sẽ có độ tan lớn hơn so với chất rắn dạng tinh thể trong 1 môi trường dung môi. Ngược lại, chất rắn dưới dạng vô định hình sẽ không ổn định như dạng tinh thể.
5. Hiện tượng hydrat hóa
Trong quá trình kết tinh chất rắn thường có thể tồn tại được 2 dạng: dạng ngậm nước hoặc dạng khan. Đối với dạng ngậm nước chất ở dạng khan sẽ có tính tan lớn hơn.
6. Độ pH của dung dịch
- Nếu axit hóa dung môi, độ tan của chất kiềm yếu sẽ tăng lên.
- Khi kiềm hóa dung môi, chất axit yếu sẽ có độ tan tăng lên.
- Những chất lưỡng tính, độ tan của các chất sẽ giảm dần khi độ pH càng gần với điểm đẳng điện và ngược lại.
7. Chất điện ly
Độ tan của các chất có thể bị giảm đi trong dung môi có chất ddiejn ly, vậy nên trước khi hòa vào dung dịch bạn cần chú ý pha loãng chất điện ly.
8. Hỗn hợp dung môi
Khi kết hợp các hỗn hợp dung môi đồng tan cùng với nước sẽ làm tăng độ tan của những chất khó tan. ví dụ: glycerin- ethanol-nước.
Cách ghi nhớ bảng tính tan
Bảng tính tan bao gồm khá nhiều thông tin, khó ghi nhớ. Hãy tham khảo cách ghi nhớ bảng tính tan hóa học 11 hiệu quả dưới đây được chúng tôi chia sẻ dưới đây:
| Hợp chất | Tính chất | Trừ |
| Axit (ở cột ion H+ và anion gốc axit tương ứng) | Đều tan | H2SiO3 |
| Bazo (hàng ion OH- và cation tương ứng) | Không tan | LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2, NH4OH. |
| Muối liti- Li+
Muối natri-Na+ Muối Kali-K+ Muối amoni-NH4+ |
Đều tan | |
| Muối bạc-Ag+ | Không tan | AgNO3, CH3COOAg |
| Muối nitrat NO3-
Muối axetat CH3COO– |
Đều tan | |
| Muối clorua Cl-
Muối bromua Br- Muối iotua I- |
Đều tan | AgCL: tạo kết tủa tắng
AgI: kết tủa vàng AgBr: kết tủa vàng nhạt PbCl2, PbI2, PbBr2. |
| Muối sunfat SO4 2- | Đều tan | BaSO4, CaSO4, PbSO4: kết tủa trắng
Ag2SO4: ít tan |
| Muối Sunfit SO3 2- | Không tan | muối với kim loại kiềm và NH4+ |
| Muối sunfua S2- | Không tan | muối với kim loại kiềm, kiềm thổ và NH4+ |
| Muối photphat PO4 3- | Không tan | muối với Na +, K+, NH4+ |
Tổng kết
Trên đây là toàn bộ nội dung tìm hiểu về bảng tính tan hóa học 11 đầy đủ, cách dễ ghi nhớ bảng tính tan. Hy vọng những thông tin hữu ích của bài viết sẽ giúp bạn đọc học tập hiệu quả hơn. Để có thêm nhiều thông tin bổ ích khác, hãy truy cập vào website của chúng tôi nhé.